Жидкость
Жи́дкость — вещество, находящееся в жидком агрегатном состоянии, занимающем промежуточное положение между твёрдым и газообразным состояниями[1].
При этом агрегатное состояние жидкости как и агрегатное состояние твёрдого тела является конденсированным, то есть таким, в котором частицы (атомы, молекулы, ионы) связаны между собой.
Основным свойством жидкости, отличающим её от веществ, находящихся в других агрегатных состояниях, является способность неограниченно менять форму под действием касательных механических напряжений, даже сколь угодно малых, практически сохраняя при этом объём[источник не указан 711 дней].
Поверхностное натяжение является характерным свойством жидкостей, отличающим их от газов. Этого нельзя сказать о различии в плотности, поскольку плотность жидкости может быть меньше плотности газа: при температуре 20 К и давлении около 3 МПа жидкий водород плавает на газообразном гелии[2].
Общая информация

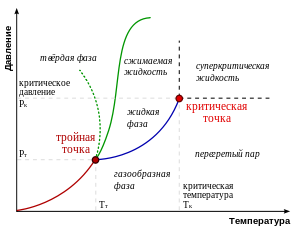
Плавлению (и кристаллизации) соответствует ветвь левее и выше тройной точки, сублимации — ветвь левее и ниже тройной точки. Зелёная пунктирная линия показывает аномальное поведение воды.
Жидкое состояние обычно считают промежуточным между твёрдым телом и газом: газ не сохраняет ни объём, ни форму, а твёрдое тело сохраняет и то, и другое[3].
Форма жидких тел может полностью или отчасти определяться тем, что их поверхность ведёт себя как упругая мембрана. Так, вода может собираться в капли. Но жидкость способна течь даже под своей неподвижной поверхностью, и это тоже означает несохранение формы (внутренних частей жидкого тела).
Молекулы жидкости не имеют определённого положения, но в то же время им недоступна полная свобода перемещений. Между ними существует притяжение, достаточно сильное, чтобы удержать их на близком расстоянии.
Вещество в жидком состоянии существует в определённом интервале температур, ниже которого переходит в твердое состояние (происходит кристаллизация либо превращение в твердотельное аморфное состояние — стекло), выше — в газообразное (происходит испарение). Границы этого интервала зависят от давления.
Как правило, вещество в жидком состоянии имеет только одну модификацию (наиболее важные исключения — это квантовые жидкости и жидкие кристаллы). Поэтому в большинстве случаев жидкость является не только агрегатным состоянием, но и термодинамической фазой (жидкая фаза).
Все жидкости принято делить на чистые жидкости и смеси. Некоторые смеси жидкостей имеют большое значение для жизни: кровь, морская вода и другие. Жидкости могут выполнять функцию растворителей.
Физические свойства жидкостей
Текучесть
Основным свойством жидкостей является текучесть. Если к участку жидкости, находящейся в равновесии, приложить внешнюю силу, то возникает поток частиц жидкости в том направлении, в котором эта сила приложена: жидкость течёт. Таким образом, под действием неуравновешенных внешних сил жидкость не сохраняет форму и относительное расположение частей, и поэтому принимает форму сосуда, в котором находится.
В отличие от пластичных твёрдых тел, жидкость не имеет предела текучести: достаточно приложить сколь угодно малую внешнюю силу, чтобы жидкость потекла.
Сохранение объёма
Одним из характерных свойств жидкости является то, что она имеет определённый объём. Жидкость чрезвычайно трудно сжать механически, поскольку, в отличие от газа, между молекулами очень мало свободного пространства. Давление, производимое на жидкость, заключённую в сосуд, передаётся без изменения в каждую точку объёма этой жидкости (закон Паскаля, справедлив также и для газов). Эта особенность, наряду с очень малой сжимаемостью, используется в гидравлических машинах.
Жидкости обычно увеличивают объём (расширяются) при нагревании и уменьшают объём (сжимаются) при охлаждении. Впрочем, встречаются и исключения, например, вода сжимается при нагревании, при нормальном давлении и температуре от 0 °C до приблизительно 4 °C.
Вязкость
Кроме того, жидкости (как и газы) характеризуются вязкостью. Она определяется как способность оказывать сопротивление перемещению одной из частей относительно другой — то есть как внутреннее трение.
Когда соседние слои жидкости движутся относительно друг друга, неизбежно происходит столкновение молекул дополнительно к тому, которое обусловлено тепловым движением. Возникают силы, затормаживающие упорядоченное движение. При этом кинетическая энергия упорядоченного движения переходит в тепловую — энергию хаотического движения молекул.
Жидкость в сосуде, приведённая в движение и предоставленная самой себе, постепенно остановится, но её температура повысится.
Образование свободной поверхности и поверхностное натяжение

Из-за сохранения объёма жидкость способна образовывать свободную поверхность. Такая поверхность является поверхностью раздела фаз данного вещества: по одну сторону находится жидкая фаза, по другую — газообразная (пар), и, возможно, другие газы, например, воздух.
Если жидкая и газообразная фазы одного и того же вещества соприкасаются, возникают силы, которые стремятся уменьшить площадь поверхности раздела — силы поверхностного натяжения. Поверхность раздела ведёт себя как упругая мембрана, которая стремится стянуться.
Поверхностное натяжение может быть объяснено притяжением между молекулами жидкости. Каждая молекула притягивает другие молекулы, стремится «окружить» себя ими, а значит, уйти с поверхности. Соответственно, поверхность стремится уменьшиться.
Поэтому мыльные пузыри и пузыри при кипении стремятся принять сферическую форму: при данном объёме минимальной поверхностью обладает шар. Если на жидкость действуют только силы поверхностного натяжения, она обязательно примет сферическую форму — например, капли воды в невесомости.
Маленькие объекты с плотностью, большей плотности жидкости, способны «плавать» на поверхности) жидкости, так как сила тяготения меньше силы, препятствующей увеличению площади поверхности. (См. Поверхностное натяжение.)
Испарение и конденсация

Испарение — постепенный переход вещества из жидкости в газообразную фазу (пар).
При тепловом движении некоторые молекулы покидают жидкость через её поверхность и переходят в пар. Вместе с тем, часть молекул переходит обратно из пара в жидкость. Если из жидкости уходит больше молекул, чем приходит, то имеет место испарение.
Конденсация — обратный процесс, переход вещества из газообразного состояния в жидкое. При этом в жидкость переходит из пара больше молекул, чем в пар из жидкости.
Испарение и конденсация — неравновесные процессы, они происходят до тех пор, пока не установится локальное равновесие (если установится), причём жидкость может полностью испариться, или же прийти в равновесие со своим паром, когда из жидкости выходит столько же молекул, сколько возвращается.
Кипение
Кипение — процесс парообразования внутри жидкости. При достаточно высокой температуре давление пара становится выше давления внутри жидкости, и там начинают образовываться пузырьки пара, которые (в условиях земного притяжения) всплывают наверх.
Смачивание
Смачивание — поверхностное явление, возникающее при контакте жидкости с твёрдой поверхностью в присутствии пара, то есть на границах раздела трёх фаз.
Смачивание характеризует «прилипание» жидкости к поверхности и растекание по ней (или, наоборот, отталкивание и нерастекание). Различают три случая: несмачивание, ограниченное смачивание и полное смачивание.
Смешиваемость
Смешиваемость — способность жидкостей растворяться друг в друге. Пример смешиваемых жидкостей: вода и этиловый спирт, пример несмешиваемых: вода и жидкое масло.
Диффузия
При нахождении в сосуде двух смешиваемых жидкостей молекулы в результате теплового движения начинают постепенно проходить через поверхность раздела, и таким образом жидкости постепенно смешиваются. Это явление называется диффузией (происходит также и в веществах, находящихся в других агрегатных состояниях).
Перегрев и переохлаждение
Жидкость можно нагреть выше точки кипения таким образом, что кипения не происходит. Для этого необходим равномерный нагрев, без значительных перепадов температуры в пределах объёма и без механических воздействий, таких, как вибрация. Если в перегретую жидкость бросить что-либо, она мгновенно вскипает. Перегретую воду легко получить в микроволновой печи.
Переохлаждение — охлаждение жидкости ниже точки замерзания без превращения в твёрдое агрегатное состояние. Как и для перегрева, для переохлаждения необходимо отсутствие вибрации и значительных перепадов температуры.
Волны плотности
Хотя жидкость чрезвычайно трудно сжать, тем не менее, при изменении давления её объём и плотность всё же меняются. Это происходит не мгновенно; так, если сжимается один участок, то на другие участки такое сжатие передаётся с запаздыванием. Это означает, что внутри жидкости способны распространяться упругие волны, более конкретно, волны плотности. Вместе с плотностью меняются и другие физические величины, например, температура.
Если при распространении волны́ плотность меняется достаточно слабо, такая волна называется звуковой волной, или звуком.
Если плотность меняется достаточно сильно, то такая волна называется ударной волной. Ударная волна описывается другими уравнениями.
Волны плотности в жидкости являются продольными, то есть плотность меняется вдоль направления распространения волны. Поперечные упругие волны в жидкости отсутствуют из-за несохранения формы.
Упругие волны в жидкости со временем затухают, их энергия постепенно переходит в тепловую энергию. Причины затухания — вязкость, «классическое поглощение», молекулярная релаксация и другие. При этом работает так называемая вторая, или объёмная вязкость — внутреннее трение при изменении плотности. Ударная волна в результате затухания через какое-то время переходит в звуковую.
Упругие волны в жидкости подвержены также рассеянию на неоднородностях, возникающих в результате хаотического теплового движения молекул.
Волны на поверхности

Если сместить участок поверхности жидкости от положения равновесия, то под действием возвращающих сил поверхность начинает двигаться обратно к равновесному положению. Это движение, однако, не останавливается, а превращается в колебательное движение около равновесного положения и распространяется на другие участки. Так возникают волны на поверхности жидкости.
Если возвращающая сила — это преимущественно силы тяжести, то такие волны называются гравитационными волнами (не путать с волнами гравитации). Гравитационные волны на воде можно видеть повсеместно.
Если возвращающая сила — это преимущественно сила поверхностного натяжения, то такие волны называются капиллярными.
Если эти силы сопоставимы, такие волны называются капиллярно-гравитационными.
Волны на поверхности жидкости затухают под действием вязкости и других факторов.
Сосуществование с другими фазами
Формально говоря, для равновесного сосуществования жидкой фазы с другими фазами того же вещества — газообразной или кристаллической — нужны строго определённые условия. Так, при данном давлении нужна строго определённая температура. Тем не менее, в природе и в технике повсеместно жидкость сосуществует с паром, или также и с твёрдым агрегатным состоянием — например, вода с водяным паром и часто со льдом (если считать пар отдельной фазой, присутствующей наряду с воздухом). Это объясняется следующими причинами:
- Неравновесное состояние. Для испарения жидкости нужно время, пока жидкость не испарилась полностью, она сосуществует с паром. В природе постоянно происходит испарение воды, также как и обратный процесс — конденсация.
- Замкнутый объём. Жидкость в закрытом сосуде начинает испаряться, но поскольку объём ограничен, давление пара повышается, он становится насыщенным ещё до полного испарения жидкости, если её количество было достаточно велико. При достижении состояния насыщения количество испаряемой жидкости равно количеству конденсируемой жидкости, система приходит в равновесие. Таким образом, в ограниченном объёме могут установиться условия, необходимые для равновесного сосуществования жидкости и пара.
- Присутствие атмосферы в условиях земной гравитации. На жидкость действует атмосферное давление (воздух и пар), тогда как для пара должно учитываться практически только его парциальное давление. Поэтому жидкости и пару над её поверхностью соответствуют разные точки на фазовой диаграмме, в области существования жидкой фазы и в области существования газообразной соответственно. Это не отменяет испарения, но на испарение нужно время, в течение которого обе фазы сосуществуют. Без этого условия жидкости вскипали бы и испарялись очень быстро.
Теория
Механика
Изучению движения и механического равновесия жидкостей и газов и их взаимодействию между собой и с твёрдыми телами посвящён раздел механики — гидроаэромеханика (часто называется также гидродинамикой). Гидроаэромеханика — часть более общей отрасли механики, механики сплошной среды.
Гидромеханика — это раздел гидроаэромеханики, в котором рассматриваются несжимаемые жидкости. Поскольку сжимаемость жидкостей очень мала, во многих случаях ею можно пренебречь. Изучению сжимаемых жидкостей и газов посвящена газовая динамика.
Гидромеханика подразделяется на гидростатику, в которой изучают равновесие несжимаемых жидкостей, и гидродинамику (в узком смысле), в которой изучают их движение.
Движение электропроводных и магнитных жидкостей изучается в магнитной гидродинамике. Для решения прикладных задач применяется гидравлика.
Основной закон гидростатики — закон Паскаля.
Движение идеальной несжимаемой жидкости описывается уравнением Эйлера. Для стационарного потока такой жидкости выполняется закон Бернулли. Вытекание жидкости из отверстий описывается формулой Торричелли.
Движение вязкой жидкости описывается уравнением Навье-Стокса, в котором возможен и учёт сжимаемости.
Упругие колебания и волны в жидкости (и в других средах) исследуются в акустике. Гидроакустика — раздел акустики, в котором изучается звук в реальной водной среде для целей подводной локации, связи и др.
Молекулярно-кинетическое рассмотрение
Агрегатное состояние вещества определяется внешними условиями, главным образом давлением и температурой . Характерными параметрами являются средняя кинетическая энергия молекулы и средняя энергия взаимодействия между молекулами (в расчёте на одну молекулу) . Для жидкостей эти энергии приблизительно равны: для твёрдых тел энергия взаимодействия намного больше кинетической, для газов — намного меньше.
Классификация жидкостей
Структура и физические свойства жидкости зависят от химической индивидуальности составляющих их частиц и от характера и величины взаимодействия между ними. Можно выделить несколько групп жидкостей в порядке возрастания сложности.
- Атомарные жидкости или жидкости из атомов или сферических молекул, связанных центральными ван-дер-ваальсовскими силами (жидкий аргон, жидкий метан).
- Жидкости из двухатомных молекул, состоящих из одинаковых атомов (жидкий водород), или ионов (жидкий натрий, ртуть), в которых частицы (ионы) связаны дальнодействующими кулоновскими силами.
- Жидкости, состоящие из полярных молекул, связанных диполь-дипольным взаимодействием (жидкий бромоводород).
- Ассоциированные жидкости, или жидкости с водородными связями (вода, глицерин).
- Жидкости, состоящие из больших молекул, для которых существенны внутренние степени свободы.
Жидкости первых двух групп (иногда трёх) обычно называют простыми. Простые жидкости изучены лучше других, из не простых жидкостей наиболее хорошо изучена вода. В эту классификацию не входят квантовые жидкости и жидкие кристаллы, которые представляют собой особые случаи и должны рассматриваться отдельно.
В гидродинамике жидкости делятся на ньютоновские и неньютоновские. Течение ньютоновской жидкости подчиняется закону вязкости Ньютона, то есть касательное напряжение и градиент скорости линейно зависимы. Коэффициент пропорциональности между этими величинами известен как вязкость[4][5][6]. У неньютоновской жидкости вязкость зависит от градиента скорости[7][8].
-
Расплавленная бронза
Статистическая теория
Наиболее успешно структура и термодинамические свойства жидкостей исследуются с помощью уравнения Перкуса-Йевика.
Если воспользоваться моделью твёрдых шаров, то есть считать молекулы жидкости шарами с диаметром , то уравнение Перкуса-Йевика можно решить аналитически и получить уравнение состояния жидкости:
где — число частиц в единице объёма, — безразмерная плотность. При малых плотностях это уравнение переходит в уравнение состояния идеального газа: . Для предельно больших плотностей, , получается уравнение состояния несжимаемой жидкости: .
Модель твёрдых шаров не учитывает притяжение между молекулами, поэтому в ней отсутствует резкий переход между жидкостью и газом при изменении внешних условий.
Если нужно получить более точные результаты, то наилучшее описание структуры и свойств жидкости достигается с помощью теории возмущений. В этом случае модель твёрдых шаров считается нулевым приближением, а силы притяжения между молекулами считаются возмущением и дают поправки.
Кластерная теория


Одной из современных теорий служит «Кластерная теория». В её основе заключена идея, что жидкость представляется как сочетание твёрдого тела и газа. При этом частицы твёрдой фазы (кристаллы, двигающиеся на короткие расстояния) располагаются в облаке газа, образуя кластерную структуру. Энергия частиц отвечает распределению Больцмана, средняя энергия системы при этом остаётся постоянной (при условии её изолированности). Медленные частицы сталкиваются с кластерами и становятся их частью. Так непрерывно изменяется конфигурация кластеров, система находится в состоянии динамического равновесия. При создании внешнего воздействия система будет вести себя согласно принципу Ле Шателье. Таким образом, легко объяснить фазовое превращение:
- При нагревании система постепенно превратится в газ (кипение)
- При охлаждении система постепенно превратится в твёрдое тело (замерзание).
По другому представлению[10][11] в основе кластерной теории жидкости, как о веществе, находящемся в конденсированном (связанном) состоянии (сохранение объёма), а не в состоянии «газоплотного» беспорядка, лежит представление о кластерах, как остаточных после перехода через точку плавления квазикристаллических динамических структурах с постоянным (для заданной температуры) средним числом разрывающихся и восстанавливающихся межкластерных и внутрикластерных межатомных связей, обеспечивающих сохранение объёма и определяющих подвижность (текучесть) и химическую активность жидкости. С ростом температуры количество атомов в кластерах уменьшается за счёт увеличения разорванных связей. Образующиеся свободные атомы (молекулы) испаряются с поверхности жидкости или остаются в межкластерном пространстве в качестве растворённого газа (пара). При температуре кипения вещество переходит в моноатомное (мономолекулярное) газообразное (парообразное) состояние.
Экспериментальные методы изучения
Структуру жидкостей изучают с помощью методов рентгеновского структурного анализа, электронографии и нейтронографии.
См. также
Примечания
- ↑ Жидкость — статья из Физической энциклопедии
- ↑ Jonas Janickis. Fizikinė chemija (лит.). — Vilnius: Mokslas, 1987. — С. 62—63.
- ↑ В технической гидромеханике иногда жидкостью в широком смысле этого слова называют и газ; при этом жидкость в узком смысле слова называют капельной жидкостью.
- ↑ «Физическая энциклопедия». В 5 томах. М.: «Советская энциклопедия», 1988
- ↑ Главный редактор А. М. Прохоров. Ньютоновская жидкость // Физический энциклопедический словарь. — М.: Советская энциклопедия. — 1983.
- ↑ Ньютоновская жидкость — статья из Физической энциклопедии
- ↑ Уилкинсон У. Л., Неньютоновские жидкости, пер. с англ., М., 1964
- ↑ Астарита Д ж., Марруччи Д ж., Основы гидромеханики неньютоновских жидкостей, пер. с англ., М., 1978
- ↑ Андреев В. Д. Избранные проблемы теоретической физики. — Киев: Аванпост-Прим,. — 2012. Архивировано 3 декабря 2013 года.
- ↑ Андреев В. Д. Крэш (crash)-конформационная кинематика ковалентной решётки алмаза при плавлении // Журнал структурной химии. — 2001. — № 3. — С. 486—495.
- ↑ Андреев В. Д. «Фактор плавления» при межатомных взаимодействиях в алмазной решётке // Химическая физика. — 2002. — № 8,т.21. — С. 35—40.
Литература
- Крокстон, К. Физика жидкого состояния. Статистическое введение. — М.: Мир, 1984. — 400 с.
Ссылки
- Статья «Жидкость» — в Физической энциклопедии.
- Жидкости // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.