Кольцевые РНК
Кольцевы́е РНК (англ. Circular RNA, circRNA) — тип молекул РНК, концы которых замкнуты друг на друга с помощью ковалентной связи между концевыми нуклеотидами. Кольцевые РНК могут образовываться из интронов или в результате выпетливания различных участков созревающего транскрипта. Хотя кольцевые РНК обычно относят к числу некодирующих РНК, в настоящее время накапливаются свидетельства того, что они могут кодировать пептиды[1]. Конкретные функции кольцевых РНК до конца не изучены, но, вероятно, они задействованы в регуляции экспрессии генов. Кольцевых РНК особенно много в головном мозге, они свободно циркулируют в плазме крови. Возможно, в будущем кольцевые РНК будут использовать в качестве биомаркеров различных видов рака.
Биогенез
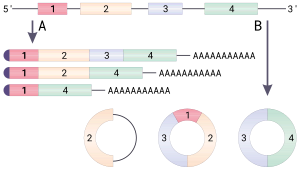
Теоретически кольцевую РНК можно получить тремя разными способами. Во-первых, в ходе сплайсинга интроны удаляются из созревающего транскрипта не в виде линейного фрагмента, а в виде лассо. Если от этого лассо отрезать «хвост», то получится кольцевая РНК. Такие интронные кольцевые молекулы накапливаются преимущественно в ядре и обозначаются ciRNA (от англ. circular intronic long non-coding RNAs). Во-вторых, в созревающем транскрипте отдельные экзоны могут выпетливаться, и такие петли могут вырезаться сплайсосомой и ковалентно замыкаться в кольцо. Так образуются кольцевые РНК, состоящие только из одного экзона. Кольцевые РНК, которые состоят исключительно из экзонов — одного или нескольких, объединяют в группу ecircRNA (от англ. exonic circRNAs) и обычно находят в цитоплазме. В-третьих, выпетливаться может участок, содержащий несколько интронов и экзонов. При вырезании и замыкании сплайсосомой такой петли формируются кольцевые РНК, содержащие и экзоны, и интроны. Они локализуются преимущественно в ядре и обозначаются EIciRNA (от англ. exon-intron circRNAs). Эти молекулы могут продолжить сплайсироваться, и после удаления интронов из них получатся кольцевые РНК, состоящие из нескольких экзонов[2].
Процесс вырезания сплайсосомой выпетливающихся участков транскрипта называется бэксплайсингом (англ. backsplicing). Зачастую интроны, окружающие один экзон, содержат комплементарные друг другу инвертированные повторы[англ.], которые, образуя водородные связи, формируют «стебелёк» петли. Выпетливание может происходить при участии специальных белков: два мономера такого белка связываются с двумя концами будущей петли, димеризуются и сближают концы так, что сплайсосома может ковалентно сшить их. Пока известны три белка, регулирующих образование некоторых кольцевых РНК: Quaking (QKI), Muscleblind (Mbl/MBNL1—3) и Fusedinsarcoma (FUS[англ.]). Так, Muscleblind регулирует образование circRNA своего же гена, связываясь с особыми участками в интронах незрелого транскрипта. Кроме того, образование кольцевых РНК зависит от белков, которые связываются с незрелой мРНК в сайтах вырезания кольцевых РНК, делая их недоступными для сплайсосомы. Обобщая, можно сказать, что биогенез кольцевых РНК — это сложный процесс, регулируемый комбинацией многих факторов, в том числе расположением инвертированных повторов и взаимодействием с белками, которые опосредуют выпетливание или, напротив, делают бэксплайсинг невозможным[2].
У некоторых архей образование рРНК протекает через стадию кольцевой молекулы-предшественницы, которая далее нарезается на отдельные рРНК[3].
Численность
Уровень синтеза кольцевых РНК варьирует в зависимости от типа клеток. В среднем соответствующие кольцевые РНК выявляются для 5—20 % активных генов, и в отдельной клетке одновременно содержится 5000—25 000 circRNA. Однако на их долю приходится совсем небольшая часть транскриптома: за редким исключением circRNA составляют 5—10 % от количества линейных матричных РНК, синтезируемых с того же гена. С одного гена, как правило, транскрибируется несколько изоформ кольцевых РНК, причём чаще всего в состав circRNA входит второй экзон гена, а первый и последний экзоны в кольцевой форме почти никогда не остаются. Образование той или иной изоформы может регулироваться. Уровень синтеза кольцевых РНК в целом сильно меняется в ходе дифференцировки клеток, однако для его существенного изменения обычно требуется несколько дней или даже недель[2].
Кругооборот
Лишённые свободных концов, кольцевые РНК не могут быть разрушены ферментами экзонуклеазами, которые разрушают многие транскрипты упорным отщеплением концевых нуклеотидов. В связи с этим средняя кольцевая РНК более стабильна, чем линейная мРНК: circRNA живёт 19—24 часа (иногда до 48 часов), что в 2—5 (до 10) раз превышает срок жизни линейных молекул. Существует несколько гипотез насчёт того, как разрушаются кольцевые РНК. Кольцевые РНК могут расщеплять эндонуклеазы, которые разрушают нуклеиновые кислоты не с концов, а вносят разрывы во внутренние части молекулы. Вероятно, в этом случае за разрушение отвечает комплекс, содержащий микроРНК, «наводящие» эндонуклеазы группы Argonaute на молекулы-мишени. В circRNA, подлежащих разрушению, некоторые остатки аденозина могут специфически метилироваться. Такие метилированные РНК распознаются особыми белками, переносящими их в места деградации рибонуклеиновых кислот — так называемые P-тельца[англ.]. В разрушении circRNA могут быть задействованы особые органеллы — аутофагосомы, среди прочего содержащие эндонуклеазы. Клетки могут выбрасывать излишние circRNA в кровь в составе внеклеточных везикул. Если для первого гипотетического пути разрушения кольцевых РНК есть некоторые экспериментальные подтверждения, то остальные модели ещё ожидают своей проверки опытом[2].
Функции
Описаны биологические эффекты как самих кольцевых РНК, так и процесса их образования. Кроме того, кольцевые РНК могут кодировать пептиды, которые тоже выполняют определённые клеточные функции. Хотя бэксплайсинг, приводящий к образованию circRNA, — событие в 100 раз более редкое, чем обычный линейный сплайсинг, вполне вероятно, что эти два процесса конкурируют друг с другом и взаимоподавляются. Возможно, именно подавление линейного сплайсинга в ходе формирования кольцевых РНК — основная клеточная функция этих молекул. Выпетливание участка незрелого транскрипта за счет комплементарного связывания инвертированных повторов в интронах само по себе может эффективно подавлять линейный сплайсинг. Кроме того, для протекания как бэксплайсинга, так и линейного сплайсинга необходимы одни и те же участки транскрипта; обычно они задействованы именно в линейном процессе, что в большинстве случаев подавляет бэксплайсинг. Действительно, показано, что с одного и того же гена кольцевые РНК и обычные линейные мРНК не синтезируются одновременно. Однако экспериментальные данные свидетельствуют о более сложной, чем обычное конкурентное подавление, связи между линейным и бэксплайсингом. Возможно, важную роль в том, какая РНК будет считываться с гена — мРНК или кольцевая, может играть скорость транскрипции. Так, альтернативный сплайсинг часто приводит к образованию лассо, содержащих интроны (то есть возможных предшественников кольцевых РНК), а это нередко происходит при ускорении транскрипции. Выбор между бэксплайсингом и линейным сплайсингом может быть основан и на более сложных механизмах. Предполагают, например, что кольцевая РНК, которая считывается с гена mbl, забирает на себя весь белковый продукт этого гена — Muscleblind. Известно, что этот белок необходим для образования линейных mbl-мРНК, поэтому, связываясь с ним и не давая ему функционировать, кольцевые mbl-РНК (circMbl) подавляют синтез своих линейных «собратьев». Не исключена и возможность комплементарного связывания кольцевых РНК с участками породивших их генов, то есть с ДНК[2].
Ряд экспериментов свидетельствует в пользу того, что EIciRNA (экзон-интронные) и ciRNA (интронные) влияют на транскрипцию собственных генов, стимулируя РНК-полимеразу II. Исследователям удалось осадить с помощью антител комплекс EIciRNA с РНК-полимеразой II, причём выяснилось, что для стимуляции полимеразы необходим ещё один компонент — малая ядерная РНК U1[англ.]. Возможно, при взаимодействии с EIciRNA U1 располагается таким образом, что стимулирует работу полимеразы. В то же время ciRNA, похоже, могут связываться непосредственно с хроматином в области «родительских» генов и повышать скорость их транскрипции. Удалось осадить, например, ciRNA под названием ci-ankrd52 в комплексе с активно работающей РНК-полимеразой II (активная форма фермента отличается особым фосфорилированием С-концевого домена). Поскольку ciRNA способны связываться и с «чужими» последовательностями ДНК, их роль в контроле экспрессии генов может быть значительной[2].
Для двух ecircRNA (экзонных, локализованных в цитоплазме) экспериментально показана способность влиять на синтез белка. Кольцевая РНК circANRIL нарушает работу комплекса белков, процессирующих рРНК, уменьшая тем самым количество функциональных рибосом и выход белка. В то же время circPABPN1 подавляет работу белка HuR[англ.], необходимого для трансляции ряда мРНК[2].
Кольцевые РНК могут служить структурной основой для сборки белковых комплексов и тем самым обеспечивать межбелковые взаимодействия. Например, благодаря circ-Foxo3 циклинзависимая киназа 2 (Cdk2) взаимодействует со своим ингибитором, p21, что приводит к остановке клеточного цикла. Кроме того, кольцевые РНК могут секвестрировать белки — ограничивать их перемещение к рабочим местам. Так, вышеупомянутая circ-Foxo3 может «запирать» в цитоплазме транскрипционный фактор E2F1 и некоторые другие белки[3].
Некоторые экзонные кольцевые РНК содержат сайты связывания негативных регуляторов экспрессии генов — микроРНК. В англоязычной литературе такие circRNA часто называют microRNA sponges — «губки, впитывающие микроРНК». Связываясь с ними, микроРНК уже не могут взаимодействовать с комплементарными мРНК-мишенями и мешать их трансляции. Например, кольцевая РНК CDR1as содержит 74 сайта связывания с микроРНК miR-7, а мышиная кольцевая РНК, считанная с гена Sry (важен для определения пола), — 16 сайтов связывания с miR-138. Лишь для немногих кольцевых РНК показана способность связываться с микроРНК, то есть это скорее исключение, чем правило. circRNA найдены у некоторых одноклеточных эукариот, у которых вообще нет микроРНК, а именно — у дрожжей Saccharomyces cerevisiae и малярийного плазмодия Plasmodium falciparum. Таким образом, связывание с микроРНК не может быть основной функцией кольцевых РНК[2].
Ряд кольцевых РНК играет важную роль в противовирусном иммунитете. Например, у кур, устойчивых к вирусу птичьего лейкоза[англ.], 12 circRNA образуются в бо́льших количествах, чем у обычных кур. Многие из этих молекул связываются с микроРНК, регулирующими экспрессию генов, которые связаны с такими иммунными процессами, как активация В-лимфоцитов и презентация антигена. Любопытно, что иммунная система тоже влияет на синтез кольцевых РНК. Например, иммунные факторы NF90 и NF110 (сплайс-варианты гена ILF3[англ.]) стимулируют образование circRNA из созревающего транскрипта в ядре. В условиях же вирусной инфекции эти белки уходят в цитоплазму, где связываются с вирусными мРНК и тормозят жизненный цикл вируса; количество ядерной circRNA при этом снижается, что может модулировать экспрессию генов. Кольцевые РНК могут участвовать в подавлении инфекции и путём связывания вирусных или клеточных микроРНК, мешающих иммунному ответу[3].
Большинство событий бэксплайсинга затрагивает экзоны и происходит в РНК генов, кодирующих белки. Трансляция большинства мРНК начинается с распознавания рибосомой видоизменённого нуклеотида на 5′-конце мРНК, так называемого кэпа. У кольцевых РНК нет свободного 5′-конца, поэтому у них не может быть и кэпа. Однако некоторые клеточные и вирусные РНК могут транслироваться в отсутствие кэпа при участии особой последовательности — IRES. С кольцевыми РНК могло бы происходить то же самое[2][3].
Искусственные circRNA, содержащие IRES и кодирующие какой-нибудь пептид, удавалось транслировать. Однако показано, что большинство кольцевых РНК в живых клетках не связаны с рибосомами, поэтому вряд ли их трансляция носит массовый характер. Пока известны две кольцевые РНК, по которым, вероятно, синтезируются белки in vivo, — это circMbl и circZNF609. Эти молекулы образуются несколько нестандартно: в первом случае бэксплайсинг затрагивает первый экзон, который, как мы помним, обычно в состав кольцевых РНК не включается, а во втором в circRNA попадает фрагмент 5′-нетранслируемой области исходного транскрипта, который обладает свойствами IRES. Возможно, синтез белков по circRNA возможен только в особых условиях, например, при стрессе — тепловом шоке[англ.] или голодании[2].
Если предположить, что какая-то кольцевая РНК содержит открытую рамку считывания с числом нуклеотидов, кратным трём, то теоретически трансляция такой РНК может протекать по механизму катящегося кольца. Результатом такой трансляции была бы теоретически бесконечная цепочка повторяющихся блоков аминокислот, и рост её ограничивался бы процессивностью рибосом. Подобные случаи пока не известны для клеточных кольцевых РНК, однако нечто похожее происходит с вироидной кольцевой РНК, ассоциированной с вирусом жёлтой пятнистости риса[2].
Методы изучения и базы данных
Последние успехи в обнаружении кольцевых РНК связаны с усовершенствованиями технологии секвенирования РНК, такими как увеличение длины одиночных прочтений[англ.], улучшение алгоритмов сопоставления РНК с известными генами и расширение библиотек[англ.] РНК. Кольцевые РНК можно отличить от линейных с помощью биоинформатического подхода (по результатам секвенирования) или «мокрым» способом — с помощью экзонуклеаз. Как упоминалось выше, эти ферменты быстро расщепляют линейные РНК, но не трогают кольцевые. С помощью экзонуклеаз идентифицировали тысячи кольцевых РНК, но всё же большинство circRNA описали благодаря высокопроизводительному секвенированию с использованием специальных алгоритмов[4].
В настоящее время функционирует несколько баз данных, посвящённых кольцевым РНК, и онлайн-инструментов для работы с ними. В их числе[5]:
- Circ2Traits — содержит информацию о кольцевых РНК, связанных с заболеваниями человека;
- CircInteractome — онлайн-инструмент для определения сайтов связывания с микроРНК и белками в кольцевых РНК;
- CircRNADb — содержит детальную информацию о хорошо изученных кольцевых РНК;
- HumanViCe — хранилище последовательностей кольцевых РНК, которые могут связываться с клеточными или вирусными микроРНК в заражённых клетках.
Клиническое значение
Кольцевые РНК в разном количестве выявляются в плазме крови, причём в периферической крови их даже больше, чем в клетках органов. Причины этого неясны, особенно если учесть тот факт, что в 25-процентной сыворотке circRNA распадаются всего через 30 секунд (в клетке средняя кольцевая РНК существует 1—2 дня). Как бы то ни было, наличие и количество некоторых кольцевых РНК в плазме крови могут служить важным показателем здоровья организма. Иными словами, кольцевые РНК можно использовать в качестве биомаркеров для диагностики и определения стадии таких патологий, как коронарные заболевания сердца, различные виды рака (в том числе лейкемия), диабет и рассеянный склероз[2].
Некоторые кольцевые РНК связаны с клеточным старением. Так, circPVT1 действует как ингибитор старения пролиферирующих фибробластов[4]. Ряд кольцевых РНК ассоциирован с возрастными изменениями организма: например, идентифицированы молекулы, связанные со старением мышц у мартышек[6].
К настоящему моменту известны 10 кольцевых РНК, вовлечённых в развитие сердечно-сосудистых и метаболических заболеваний (например, сахарного диабета). Уже упоминавшаяся circANRIL может защищать от атеросклероза, подавляя созревание рРНК и сдерживая этим деление клеток, избыточная пролиферация которых ведёт к формированию атеросклеротических бляшек[англ.]. Кольцевая РНК под названием MICRA может сигнализировать о нарушениях работы левого желудочка, возникших вследствие инфаркта миокарда. При гипертрофии сердца и сердечной недостаточности наблюдается снижение синтеза ряда кольцевых РНК[2].
Для некоторых клеточных РНК показана связь с сахарным диабетом. Известно, что гиперпродукция микроРНК miR-7 в β-клетках поджелудочной железы способствует развитию диабета, а гиперпродукция ciRS-7 — кольцевой РНК, связывающей miR-7, — в этих клетках, напротив, улучшает секрецию инсулина[4].
В нервных тканях различных организмов (от плодовой мушки до человека) находят особенно много кольцевых РНК. Возможно, это связано с большей распространённостью альтернативного сплайсинга в нейронах. Кроме того, кольцевые РНК в них могут выполнять особые функции, связанные с проведением нервных импульсов. Белок Qki[англ.], задействованный в образовании circRNA, участвует в развитии олигодендроцитов и регулирует миелинизацию, а также подавляет образование дендритов в центральной нервной системе. Мутации гена этого белка связывают с атаксией и шизофренией[2]. Есть свидетельства и о связи кольцевых РНК с болезнью Альцгеймера[4][6].
Более 20 кольцевых РНК связаны с развитием разных видов рака, таких как колоректальный рак, рак яичника, мочевого пузыря, молочной железы, печени, желудка, почек и предстательной железы. Онкологические процессы часто сопровождаются транслокациями, которые приводят к появлению специфичных для определённых опухолей видов circRNA. Чаще всего кольцевые РНК, ассоциированные с развитием рака, функционируют как «губки» для микроРНК[2].
См. также
Примечания
- ↑ Pamudurti Nagarjuna Reddy, Bartok Osnat, Jens Marvin, Ashwal-Fluss Reut, Stottmeister Christin, Ruhe Larissa, Hanan Mor, Wyler Emanuel, Perez-Hernandez Daniel, Ramberger Evelyn, Shenzis Shlomo, Samson Moshe, Dittmar Gunnar, Landthaler Markus, Chekulaeva Marina, Rajewsky Nikolaus, Kadener Sebastian. Translation of CircRNAs (англ.) // Molecular Cell. — 2017. — April (vol. 66, no. 1). — P. 9—21.e7. — ISSN 1097-2765. — doi:10.1016/j.molcel.2017.02.021.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Holdt Lesca M., Kohlmaier Alexander, Teupser Daniel. Molecular roles and function of circular RNAs in eukaryotic cells (англ.) // Cellular and Molecular Life Sciences. — 2017. — 7 November (vol. 75, no. 6). — P. 1071—1098. — ISSN 1420-682X. — doi:10.1007/s00018-017-2688-5.
- ↑ 1 2 3 4 Wang Man, Yu Fei, Wu Wei, Zhang Yuan, Chang Wenguang, Ponnusamy Murugavel, Wang Kun, Li Peifeng. Circular RNAs: A novel type of non-coding RNA and their potential implications in antiviral immunity (англ.) // International Journal of Biological Sciences. — 2017. — Vol. 13, no. 12. — P. 1497—1506. — ISSN 1449-2288. — doi:10.7150/ijbs.22531.
- ↑ 1 2 3 4 Greene John, Baird Anne-Marie, Brady Lauren, Lim Marvin, Gray Steven G., McDermott Raymond, Finn Stephen P. Circular RNAs: Biogenesis, Function and Role in Human Diseases (англ.) // Frontiers in Molecular Biosciences. — 2017. — 6 June (vol. 4). — ISSN 2296-889X. — doi:10.3389/fmolb.2017.00038.
- ↑ Szabo Linda, Salzman Julia. Detecting circular RNAs: bioinformatic and experimental challenges (англ.) // Nature Reviews Genetics. — 2016. — November (vol. 17, no. 11). — P. 679—692. — ISSN 1471-0056. — doi:10.1038/nrg.2016.114.
- ↑ 1 2 Panda Amaresh C., Grammatikakis Ioannis, Munk Rachel, Gorospe Myriam, Abdelmohsen Kotb. Emerging roles and context of circular RNAs (англ.) // Wiley Interdisciplinary Reviews: RNA. — 2016. — 9 September (vol. 8, no. 2). — P. e1386. — ISSN 1757-7004. — doi:10.1002/wrna.1386.
Литература
- Wang, S., Xiao, F., Li, J., Fan, X., He, Z., Yan, T., ... & Yang, D. (2022). Circular RNAs Involved in the Regulation of the Age-Related Pathways. International Journal of Molecular Sciences, 23(18), 10443. doi:10.3390/ijms231810443
- Misir, S., Wu, N., & Yang, B. B. (2022). Specific expression and functions of circular RNAs. Cell Death & Differentiation, 29(3), 481-491. PMID 35169296 PMC 8901656 doi:10.1038/s41418-022-00948-7
- Liu, C. X., & Chen, L. L. (2022). Circular RNAs: Characterization, cellular roles, and applications. Cell. 185(12), P2016-2034 PMID 35584701 doi:10.1016/j.cell.2022.04.021
- Sinha, T., Panigrahi, C., Das, D., & Chandra Panda, A. (2022). Circular RNA translation, a path to hidden proteome. Wiley Interdisciplinary Reviews: RNA, 13(1), e1685. PMID 34342387 PMC 7613019 doi:10.1002/wrna.1685
- Chen X., Zhou M., Yant L., Huang C. (2022). Circular RNA in disease: Basic properties and biomedical relevance. Wiley Interdiscip. Rev. RNA 22, e1723. 10.1002/wrna.1723 PMID 35194939 doi:10.1002/wrna.1723
- He, Z., Ji, H., Xia, B., Cao, X., Huang, Y., & Zhu, Q. (2024). Invention of circRNA promoting RNA to specifically promote circRNA production. Nucleic Acids Research, 52(17), e83-e83. PMID 39119897 PMC 11417354 doi:10.1093/nar/gkae693
- Chen, R., Wang, S. K., Belk, J. A., Amaya, L., Li, Z., Cardenas, A., ... & Chang, H. Y. (2023). Engineering circular RNA for enhanced protein production. Nature biotechnology, 41(2), 262-272. PMID 35851375 PMC 9931579 doi:10.1038/s41587-022-01393-0
- Zhang, Z., Fu, Y., Ju, X., Zhang, F., Zhang, P., & He, M. (2024). Advances in Engineering Circular RNA Vaccines. Pathogens, 13(8), 692. PMID 39204292 PMC 11356823 doi:10.3390/pathogens13080692
Ссылки
- Минина Е. Власть колец: всемогущие кольцевые РНК. Биомолекула (13 февраля 2018). Дата обращения: 13 декабря 2018. Архивировано 2 ноября 2018 года.
- Kristensen, L. S., Andersen, M. S., Stagsted, L. V., Ebbesen, K. K., Hansen, T. B., & Kjems, J. (2019). The biogenesis, biology and characterization of circular RNAs. Nature Reviews Genetics, 1-17.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |








