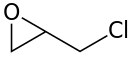
Эпихлоргидрин
| Эпихлоргидрин | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
2-хлорметилоксиран | ||
| Традиционные названия |
Эпихлоргидрин, 3-хлор-1,2-эпоксипропан, хлорметилоксиран |
||
| Хим. формула | С3H5ClO | ||
| Рац. формула | СH2-O-CH-CH2Cl | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость с раздражающим запахом хлороформа | ||
| Молярная масса | 92,524 ± 0,005 г/моль | ||
| Плотность | 1,18066 г/см³ | ||
| Энергия ионизации | 10,6 эВ[1] и 10,2 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -48 °C | ||
| • кипения | 117,9 °C | ||
| • вспышки | +40,6 °C | ||
| • самовоспламенения | 415,6 °C | ||
| Пределы взрываемости | 3,8 об.%[1] | ||
| Давление пара | 13,1 мм рт. ст. (+20 °С), | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 6,5 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,43805 | ||
| Классификация | |||
| Рег. номер CAS | 106-89-8 | ||
| PubChem | 7835 | ||
| Рег. номер EINECS | 203-439-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | TX4900000 | ||
| ChEBI | 37144 | ||
| ChemSpider | 13837112 | ||
| Безопасность | |||
| Предельная концентрация | 1 мг/м³ | ||
| ЛД50 | 90 мг/кг (крысы, перорально) | ||
| Токсичность | Высокотоксичное вещество, сильно раздражает слизистые оболочки дыхательных путей (ирритант). | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Эпихлоргидрин (хлорметилоксиран) — органическое вещество, хлорпроизводное окиси пропилена, с формулой СH2(O)CH-CH2Cl. Широко применяется в органическом синтезе, используется в производстве эпоксидных смол и глицерина[3]. Высокотоксичен, ирритант.
Синтез
Эпихлоргидрин получают из пропилена, который хлорируют при температуре 500 °С и давлении 18 атмосфер до аллилхлорида:
Затем аллилхлорид подвергается действию хлорноватистой кислоты и получают изомерные дихлоргидрины глицерина:
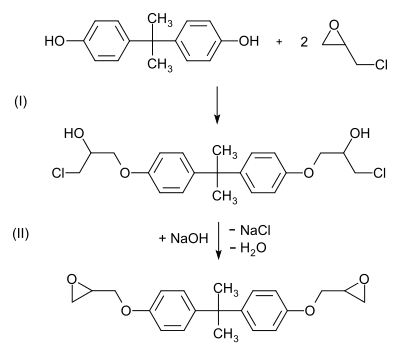
Далее на дихлоргидрины глицерина действуют щёлочью (NaOH), в результате чего образуется эпихлоргидрин:[4]
Образовавшийся эпихлоргидрин отделяют перегонкой с паром и дистилляцией. Также его можно получить восстановлением хлорированного акролеина[5].
Физические свойства
Представляет собой бесцветную подвижную прозрачную жидкость с раздражающим запахом хлороформа, плохо растворимую в воде, хорошо в большинстве органических растворителях. С водой образует азеотропную смесь с температурой кипения +88 °С и содержит 75 % эпихлоргидрина. Образует азеотропные смеси с большим числом органических жидкостей. Вследствие наличия асимметричного атома углерода эпихлоргидрин оптически активен[5].
Химические свойства
Эпихлоргидрин химически высокореакционное соединение, имеющее активную эпоксидную группу и подвижный атом хлора[6].
Реакция галогенирования
При взаимодействии хлора с эпихлоргидрином при обычных условиях образуется окись 3,3-дихлорпропилена (3,3-дихлорэпоксипропилен)[6]:
Реакция гидрохлорирования
Легко присоединяет хлороводород при обычной температуре как в растворе, так и в безводной среде, с образованием 1,3-дихлоргидрина[6]:
Реакция дегидрохлорирования
В присутствии небольших количеств щёлочи эпихлоргидрин легко присоединяет соединения содержащие один или несколько подвижных атомов водорода, с образованием хлоргидринов[6]:
При увеличении концентрации щёлочи реакция идет с отщеплением хлористого водорода и с восстановлением эпоксидной группы, но уже в другом положении[6]:
Реакция гидролиза
При избытке щёлочи (чаще всего применяют карбонат натрия) и при температуре 100 °С эпихлоргидрин медленно превращается в глицерин[6]:
Реакция гидратации
в присутствии разбавленных неорганических кислот (серной или ортофосфорной) эпихлоргидрин образует α-монохлоргидрин глицерина[6]:
С повышением температуры повышается гидратация эпихлоргидрина.
Реакция этерификации
При взаимодействии эпихлоргидрина со спиртами происходит раскрытие эпоксидного кольца с образованием гидроксильной группы в положении 2 и с образованием простого эфира[6]:
С карбоновыми кислотами эпихлоргидрин образует сложные эфиры хлоригидрина, например с ледяной уксусной кислотой при нагревании до 180 °С образуется преимущественно 1-хлор-2-гидрокси-3-пропилацетат[6]:
Реакция аминирования
Эпихлоргидрин уже при обычной температуре присоединяет аммиак или амины с раскрытием цикла[6]:
Реакция конденсации
Эпихлоргидрин реагирует с дифенилолпропаном с образованием полимерного диглицидного эфира[6]:
Данная реакция является примером получения эпоксидных смол, получивших за последнее время в силу своих исключительных свойств очень широкое распространение[6].
Реакция полимеризации
Эпихлоргидрин способен полимеризоваться. В зависимости от применяемого катализатора получаются подвижные жидкости, высоковязкие масла или смолоподобные продукты[6].
Применение
Применяется как полупродукт для синтеза производных глицерина, красителей и поверхностно-активных веществ; для получения синтетических материалов (главным образом, эпоксидных смол).
Токсикология и безопасность
Общий характер действия
Обладает раздражающим и аллергическим действием. В опытах на животных избирательно поражает почки. Проникает через кожу[3].
Эпихлоргидрин является высокотоксичным и огнеопасным соединением[5]. Пары эпихлоргидрина при вдыхании даже небольших концентраций вызывают тошноту, головокружение и слезотечение, а при длительном воздействии приводят к более тяжёлым последствиям (нередко возникают сильнейшие отёки лёгких)[3]. Эпихлоргидрин при попадании на кожу и длительном контакте вызывает дерматиты, вплоть до поверхностных некрозов. Все работы с эпихлоргидрином необходимо проводить в резиновых перчатках, резиновом фартуке, а при сильной загазованности его парами — в противогазе марки А[7].
Безопасность
Эпихлоргидрин — легковоспламеняющееся вещество. При возгорании тушить диоксидом углерода, пеной или водой, равномерно распределяя её по поверхности.
ПДК в воздухе рабочей зоны производственных помещений не должен превышать 1 мг/м³, ПДК в атмосферном воздухе населённых мест 0,2 мг/м³ (рекомендуемая)[6].
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0254.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 1 2 3 Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Изд. 7-е, пер. и доп. В трёх томах. Том I. Органические вещества. Под ред. засл. деят. науки проф. Н. В. Лазарева и докт. мед. наук Э. Н. Левиной. Л., «Химия», 1976. 592 стр., 27 табл., библиография — 1850 названий.
- ↑ Григорьев А. П., Федотова О. Я. Лабораторный практикум по технологии пластических масс. В двух частях. Часть 2. Поликонденсационные и химически модифицированные пластические массы. — Учеб. пособие для химико-технол. вузов. - 2-е изд., перераб. и доп.. — М.: Высшая школа, 1977. — Т. 2. — 264 с.
- ↑ 1 2 3 Гольдберг М. М., Ермолаева Т. А., Лившиц М. Л., Лубман А. М., Рассудова Н. С., Сергеева 3. И., Фартунин В. И. Сырьё и полупродукты для лакокрасочных материалов / Под ред. М. М. Гольдберга.. — М.: Химия, 1978. — 512 с.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Ошин Л.А. Промышленные хлорорганические продукты. — М.: Химия, 1978. — 656 с.
- ↑ Брацыхин Е. А., Шульгина Э. С. Технология пластических масс. — Учебное пособие для техникумов. – 3-е изд., перераб. и доп.. — Л.: Химия, 1982. — 328 с.
















![{\displaystyle {\mathsf {RH+CH_{2}CH{-}O{-}CH_{2}Cl{\xrightarrow[{}]{[NaOH]}}RCH_{2}{-}CHOH{-}CH_{2}Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c6c11fc9527670f8e102cad0bc155f4f4cb3a56)
![{\displaystyle {\mathsf {RCH_{2}{-}CHOH{-}CH_{2}Cl{\xrightarrow[{}]{[NaOH]}}RCH_{2}{-}CH{-}O{-}CH_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/48187b3c9ce24650f951942b4b4e3450dc78ee39)

![{\displaystyle {\mathsf {CH_{2}CH{-}O{-}CH_{2}Cl+H_{2}O{\xrightarrow[{}]{[H_{2}SO_{4}]}}CH_{2}OH{-}CHOH{-}CH_{2}Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2e0f3c86481828380b4720b2a6e4991b60fdc4f2)